行政書士
東京国際法務事務所
|
什么是GVP、GVP不管是自行生产药品的企业,还是委托他人生产药品或进口并销售药品的企业,都需要获得"制造销售业许可"才能将药品推向市场。 对于自行生产的药品,负责其品质和安全管理是理所当然的,但对于外部委托生产或进口的药品,也有责任监督委托方是否进行了适当的品质管理。 此外,如果在某种药品流入市场后发现意外的副作用,药品制造销售商也有责任承担责任。即使这种副作用是由制造方或进口方的生产过程引起的,负责销售后安全管理的人员仍然是医药品制造销售商。
这里所提到的品质管理标准称为"Good Quality Practice (GQP)",而售后安全管理的标准称为"Good Vigilance Practice (GVP)"。
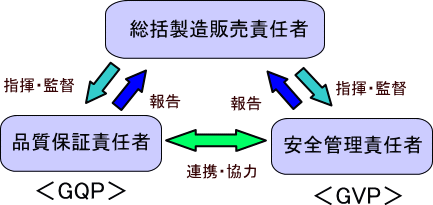
l 什么是GQP GQP(Good Quality Practice)是“良好品质实践”的缩写,简单来说,它是用于检查自家生产工厂或委托制造商是否进行了适当的生产管理和品质管理的基准。
以下是GQP的主要内容: 1. 总括制造销售责任者的职责(第3条) 2. 与品质管理工作相关的组织和员工(第4条) 3. 品质标准书(第5条) 4. 与品质管理工作程序相关的文件(第6条) 5. 与制造商等的协议(第7条) 6. 品质保证责任者的职责(第8条) 7. 出货管理到市场(第9条) 8. 确保适当的生产管理和品质管理(第10条) 9. 与品质相关的信息和处理品质问题(第11条) 10. 回收处理(第12条) 11. 自检(第13条) 12. 教育培训(第14条) 13. 药品储存等管理(第15条) 14. 文件和记录管理(第16条)
l 什么是GVP GVP(Good Vigilance Practice)是“良好警戒实践”的缩写。GQP(Good Quality Practice)是为了确保药品的质量,而GVP则是关于制造销售后的安全管理标准。 尽管GQP中也有在药品市场销售后进行调查和报告的义务,但GQP主要是针对质量问题,而GVP主要涉及副作用和感染症等与销售后安全管理相关的事项。 GVP的必要性可以分为三个主要原因: 第一,为了改善由产品设计缺陷或制造过程错误等导致的产品缺陷和问题。 第二,为了应对在将产品出货到市场后,只有在多个设施中才会发现的产品缺陷和问题。 第三,为了在制造销售后持续收集各种信息而不间断,以便进行必要的措施。 通过制定GVP,并通过制造销售商的持续改进努力,最大目标是防止卫生危害的发生和扩大。
以下是适用于GVP(Good Vigilance Practice)的主要内容: 1. 总括制造销售责任者的职责(第3条) 2. 与安全保障工作相关的组织和员工(第4条) 3. 制定制造销售后安全管理工作程序书(第5条) 4. 安全管理责任者的职责(第6条) 5. 信息收集(第7条)、评估、制定措施(第8条)和实施(第9条) 6. 上市后调查(第10条) 7. 自检(第11条)、教育培训(第12条)
注:根据医药品、医疗器械等产品的种类和级别不同,GQP和GVP的适用条件和要求各不相同。若需确定具体要求,请与本所联系。 |